
Комп'ютеризовані системи підтримки клінічних рішень, відомі як CDSS, означають глибокі зміни в сучасному охороні здоров'я. Ці системи призначені для покращення та підтримки клініцистів у їх складних процесах прийняття рішень. З моменту їх початкового впровадження в 1980-х роках CDSS швидко еволюціонували. Зараз вони переважно інтегровані в електронні медичні записи та різні комп'ютеризовані клінічні робочі процеси, що стало можливим завдяки зростаючому глобальному впровадженню сучасних електронних медичних записів. Однак, незважаючи на ці досягнення, залишається багато невизначеностей щодо впливу CDSS на медичних працівників, результати лікування пацієнтів та пов'язані витрати. Хоча останні десятиліття стали свідками численних успішних історій впровадження CDSS, значні невдачі також підкреслили вроджені ризики. У цій статті ми представляємо сучасний огляд застосування систем підтримки клінічних рішень у медицині, охоплюючи різні типи, актуальні випадки використання з підтвердженою ефективністю, загальні виклики та потенційні недоліки.
Що таке система підтримки клінічних рішень?
Система підтримки клінічних рішень (CDSS) — це застосунок, призначений для аналізу даних з метою допомоги медичним працівникам у прийнятті обґрунтованих рішень та покращенні догляду за пацієнтами. Це спеціалізована форма більш широкої системи підтримки рішень (DSS), яка зазвичай використовується в управлінні бізнесом. Основна мета CDSS полягає в використанні управління знаннями для надання клінічних рекомендацій на основі різних аспектів інформації, пов'язаної з пацієнтом. Ці системи сприяють інтегрованим робочим процесам, пропонують допомогу в реальному часі під час надання медичної допомоги та надають рекомендації щодо планів лікування.
У контексті систем підтримки клінічних рішень часто використовують аналіз даних для вивчення медичної історії пацієнта разом із відповідними клінічними дослідженнями. Цей аналіз допомагає передбачити потенційні події, такі як взаємодії лікарських засобів або виявлення симптомів захворювання.
Плануєте запуск цифрового продукту?
Розробляємо стабільні та масштабовані веб- і мобільні застосунки для бізнесу.
Аліна
Клієнт-менеджер

Класифікація систем підтримки клінічних рішень
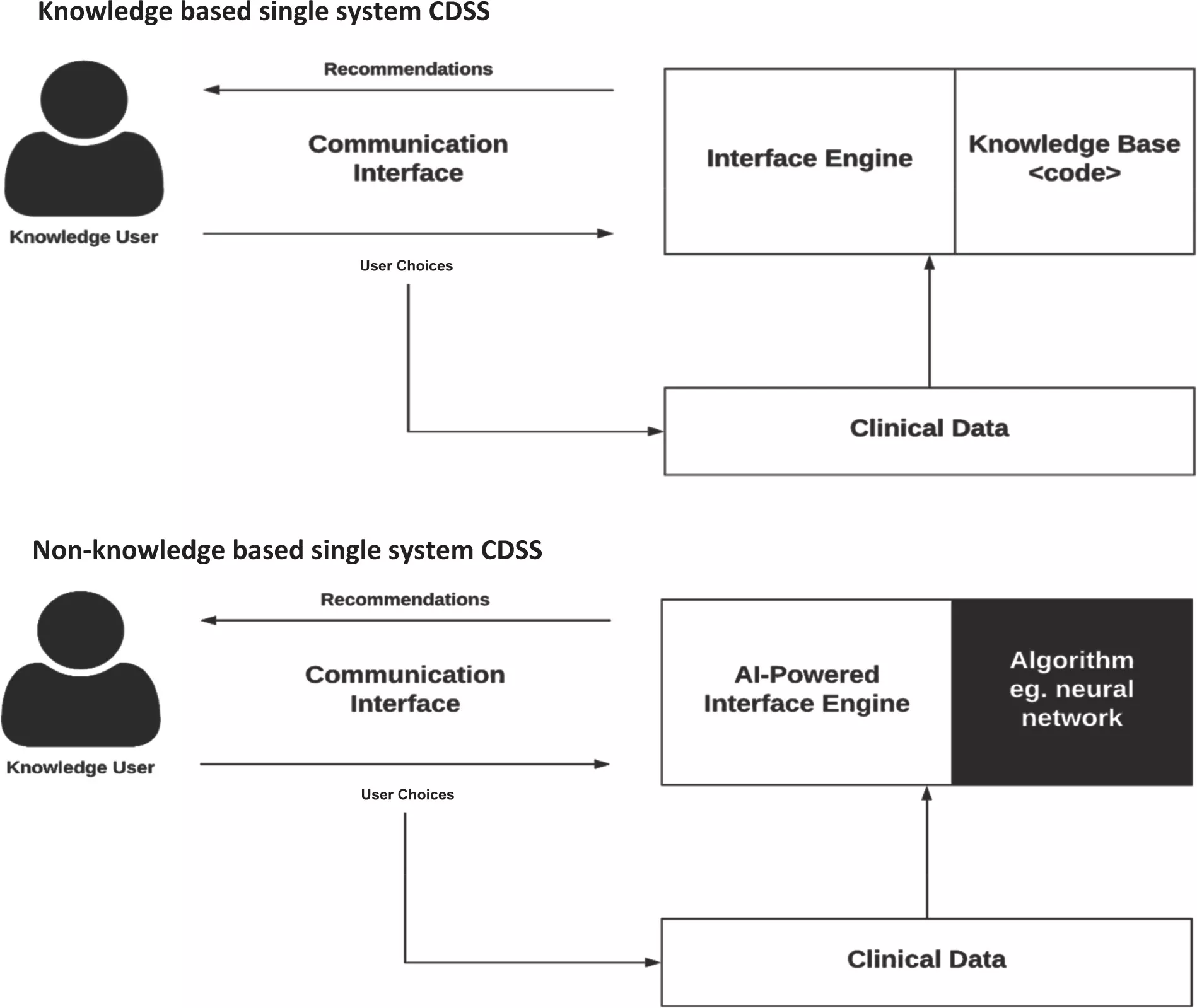
CDSS були класифіковані за різними типами та категоріями, враховуючи час втручання та чи є їхнє надання активним чи пасивним. Ці системи зазвичай класифікуються на дві основні категорії: засновані на знаннях та не засновані на знаннях.
У системах підтримки прийняття клінічних рішень на основі знань правила формулюються, зазвичай у формі операторів IF-THEN. Система отримує відповідні дані, оцінює ці правила та генерує відповідну дію або результат. Ці правила можуть бути встановлені на основі літературних, практичних або специфічних для пацієнта даних.
З іншого боку, системи підтримки прийняття клінічних рішень, що не базуються на знаннях, все ще покладаються на джерела даних, але використовують такі технології, як штучний інтелект (AI), машинне навчання (ML) або статистичне розпізнавання шаблонів для прийняття рішень, а не є явно запрограмованими з експертними медичними знаннями. Ця категорія представляє швидко зростаючий випадок використання AI в медицині, хоча вона стикається з викликами. До цих викликів належать розуміння обґрунтування рекомендацій, згенерованих AI (часто називаються "чорними ящиками"), та проблеми, пов'язані з доступністю даних. На даний момент системи підтримки прийняття клінічних рішень, що не базуються на знаннях, ще не досягли широкого впровадження. Обидва типи систем підтримки прийняття клінічних рішень мають спільні компоненти, хоча й з тонкими відмінностями.
Мета систем підтримки клінічних рішень (CDSS)
Основна мета системи підтримки клінічних рішень полягає в тому, щоб допомогти медичним працівникам аналізувати дані пацієнтів і використовувати цю інформацію для точного встановлення діагнозів. CDSS надають цінну інформацію клініцистам та лікарям первинної ланки, з загальною метою підвищення якості медичної допомоги, що надається їх пацієнтам.
Інструменти CDSS виконують різні функції, такі як надання нагадувань про профілактичну допомогу, видача попереджень про потенційні взаємодії лікарських засобів, які можуть становити ризик, та інформування клініцистів про заплановані надмірні тести для їх пацієнтів. Таким чином, використання CDSS може призвести до зниження витрат і підвищення оперативної ефективності в медичних установах.
Більше того, деякі медичні працівники використовують CDSS для виявлення випадків, коли пацієнти могли отримати неправильні діагнози або їм були призначені неправильні дози лікарських засобів. Такі помилки позначаються та додаються до списків проблем, а ці дані включаються до звітів з управління здоров'ям населення (PHM). Ці звіти, у свою чергу, слугують основою для ініціатив з покращення якості в медицині.
Які переваги пропонує підтримка клінічних рішень?
При оцінці систем підтримки клінічних рішень важливо враховувати як переваги, так і недоліки. Ось деякі переваги, пов'язані з системами підтримки клінічних рішень (CDSS):
- Мінімізація медичних помилок: CDSS допомагає зменшити ймовірність медичних помилок, надаючи своєчасну та точну інформацію про взаємодії лікарських засобів, дози та протипоказання.
- Централізований інформаційний репозиторій: Виконуючи функцію центрального репозиторію, CDSS консолідує всю відповідну інформацію, забезпечуючи медичних працівників комплексними даними під рукою.
- Зменшення ризиків помилкової діагностики: Надаючи інсайти та рекомендації на основі доступних даних, CDSS сприяє зниженню ризиків помилкової діагностики та покращенню точності діагностики.
- Постійна доставка інформації: CDSS забезпечує постійну та надійну доставку інформації всій команді охорони здоров'я, сприяючи стандартизованим практикам та покращуючи співпрацю.
- Підвищена ефективність: Практикуючі медики отримують вигоду від підвищеної ефективності, оскільки CDSS спрощує процеси прийняття рішень, що дозволяє швидше та більш обґрунтовано реагувати.
- Покращення якості медичних послуг: Використання CDSS сприяє загальному покращенню медичних послуг, підтримуючи прийняття рішень на основі доказів та дотримання найкращих практик.
Хоча ці переваги є суттєвими, важливо визнати виклики, пов'язані з впровадженням CDSS. Інтеграція в складні клінічні робочі процеси, потенційні проблеми з сумісністю з іншим програмним забезпеченням та постійний приплив нових медичних даних, які можуть не бути своєчасно включеними, створюють значні труднощі. Крім того, значний обсяг даних, інтегрованих в існуючі системи, може ускладнити обслуговування додатків та інфраструктури. Розуміння як переваг, так і викликів є важливим для прийняття обґрунтованих рішень щодо впровадження систем підтримки клінічних рішень.
Випадки використання та вимоги галузі до систем підтримки клінічних рішень
Системи підтримки клінічних рішень (CDS) пропонують різноманітні застосування в галузі охорони здоров'я, значно впливаючи на догляд за пацієнтами. Ці системи відіграють важливу роль у виявленні вірусів, персоналізованій терапії раку та різних аспектах медичного лікування. Нижче наведені значні приклади, що ілюструють випадки використання та застосування систем підтримки клінічних рішень в різних установах:
Зниження рівня смертності від сепсису
Лікарня в Алабамі впровадила комп'ютеризований алгоритм спостереження, що призвело до 50% зниження рівня смертності від сепсису. Аналітика в реальному часі надала своєчасні сповіщення для діагностики сепсису та нагадування про оптимальне лікування.
Спеціалізована підтримка для медсестер у Mayo Clinic
Mayo Clinic розробляє спеціалізовану систему підтримки клінічних рішень для медсестер, щоб проводити точні телефонні скринінги для пацієнтів, які шукають поради або призначення. Стандартизовані запитання забезпечують всебічну інформацію про пацієнтів.
Генетичне тестування та відвідування відділення невідкладної допомоги
Університет Хардінг у співпраці з медичним центром Unity Health-White County виявив, що поєднання CDSS з даними генетичного тестування зменшило відвідування відділення невідкладної допомоги більш ніж на 40% і повторні госпіталізації більш ніж на 50%.
Керівництво з травм голови в Yale та Mayo Clinic
Yale та Mayo Clinic розробили застосунок CDSS для пацієнтів з травмами голови, дотримуючись галузевих стандартів. Система значно зменшила кількість непотрібних КТ-сканувань, надаючи індивідуальні рекомендації щодо лікування.
Зменшення непотрібних лабораторних тестів у Міністерстві у справах ветеранів
Інструменти підтримки клінічних рішень, впроваджені в Міністерстві у справах ветеранів в Індіані, зменшили кількість непотрібних лабораторних тестів більш ніж на 11%, заощадивши пацієнтам до 150 000 доларів без шкоди для якості медичного обслуговування.
Окрім цих успішних прикладів, системи підтримки клінічних рішень пропонують різноманітні інші переваги, включаючи:
- Розрахунок дозування лікарських засобів.
- Виявлення умов, що підлягають звітуванню, через аналіз електронних медичних записів (EHR).
- Оцінка рекомендацій щодо формулювання лікарських засобів.
- Ініціювання автоматизованих нагадувань про прийом ліків або візити.
- Аналіз індексів тяжкості захворювань для пропозиції лікування.
- Більше того, машинне навчання та штучний інтелект все більше інтегруються в CDSS, демонструючи свою потужність у медичній аналітиці. Помітні досягнення включають зниження часу виявлення сепсису на 12 годин та генерацію погодинних прогнозів для пацієнтів у реанімації за допомогою інструментів глибокого навчання.
Оскільки медична галузь продовжує використовувати передові аналітичні техніки, переваги систем підтримки клінічних рішень стають все більш очевидними. Ці системи, які працюють на основі машинного навчання та штучного інтелекту, доводять свою важливість у наданні високоякісних медичних послуг. Наведені приклади підкреслюють важливість і ефективність впровадження систем підтримки клінічних рішень у медичну практику.
Як розробити систему підтримки клінічних рішень
Створення системи підтримки клінічних рішень (CDSS) є важливим для сучасних медичних закладів та практиків. CDSS відіграє ключову роль в оптимізації надання медичних послуг, управляючи великими обсягами даних, мінімізуючи повторні тести та підвищуючи безпеку пацієнтів. Система призначена для запобігання помилкам, ускладненням та повторним госпіталізаціям, демонструючи свою значущість у медичній сфері. Інструменти CDSS та приклади в охороні здоров'я демонструють її здатність швидко сортувати і надавати цифрову інформацію.
Ось посібник про те, як створити систему підтримки клінічних рішень:
Розуміння типів CDSS
Системи CDSS поділяються на дві широкі категорії: системи на основі знань та системи, що не ґрунтуються на знаннях. Системи на основі знань визначають правила для витягання даних та оцінки правил, тоді як системи, що не ґрунтуються на знаннях, використовують машинне навчання та штучний інтелект.
Обсяг функцій
CDSS виконує різноманітні функції, включаючи призначення лікарських засобів, діагностику, лікування захворювань, системи сповіщення та відпуск лікарських засобів. Ці функції перетворюються на звіти та інструменти робочого процесу, що сприяє безпеці пацієнтів, зменшенню витрат, клінічному управлінню та спрощенню адміністративних процесів.
Інтеграція даних і знань
Використовуйте дані пацієнтів та медичні знання, зберігаючи їх у механізмі висновків. Цей механізм, коли його запитують, надає інформацію та рекомендації, специфічні для випадку. Забезпечте безперебійну інтеграцію в існуючу ІТ-інфраструктуру.
Дизайн інтерфейсу користувача
Розробіть CDSS як настільний або веб-застосунок, або навіть експериментуйте з мобільним додатком. Мета полягає в створенні зручного інтерфейсу, який забезпечує легкий доступ до інформації та рекомендацій.
Сумісність
Забезпечте сумісність та інтеграцію з іншими системами охорони здоров'я та базами даних. Ця безшовна інтеграція дозволяє ефективно управляти даними та забезпечує доступність для точного діагнозу та покращення медичних послуг.
Впровадження
Інтегруйте CDSS у вже існуючу технологічну інфраструктуру медичного закладу. Цей процес має бути плавним і не порушувати щоденну діяльність.
Тестування та оптимізація
Проведіть ретельне тестування, щоб переконатися, що CDSS працює точно та ефективно. Оптимізуйте систему на основі відгуків та оцінок продуктивності.
Навчання та впровадження
Надайте навчання медичним працівникам для ефективного використання CDSS. Сприяйте широкому впровадженню, щоб максимізувати переваги системи.
На завершення, розробка системи підтримки клінічних рішень передбачає розуміння типів CDSS, визначення його функціональних можливостей, інтеграцію даних та знань, проектування зручного інтерфейсу, забезпечення сумісності, впровадження системи, тестування, оптимізацію та сприяння впровадженню через навчання. Ці кроки сприяють створенню ефективного та цінного інструменту в сфері сучасної охорони здоров'я.
Перелік для впровадження системи підтримки клінічних рішень
Впровадження системи підтримки клінічних рішень (CDSS) в організаціях охорони здоров'я є критично важливим завданням, яке вимагає ретельного планування та виконання. Незалежно від технічної основи, успіх впровадження CDSS є важливим для медичних працівників, і будь-які помилки можуть мати значні наслідки. Ось комплексний перелік, який допоможе в плануванні та впровадженні CDSS в організації охорони здоров'я:
1. Формування команди
Оцінка готовності
- Оцініть готовність організації прийняти та адаптуватися до нового CDSS.
- Переконайтеся, що є основна команда, яка розуміє операції CDSS і готова адаптуватися.
Подолання опору
- Навчайте медичних працівників про переваги та зручність використання CDSS.
- Демонструйте успішні історії з інших організацій, які отримали вигоду від впровадження CDSS.
Співпраця
- Ініціюйте групові обговорення, в які залучайте лікарів, медсестер та ІТ-персонал.
- Залучайте клінічних лідерів, осіб з технічними знаннями, щоб сприяти позитивним обговоренням.
Вирішення проблем
- Оцініть внутрішні ресурси для впровадження CDSS.
- Визначте та виріште будь-який опір з боку адміністративних зацікавлених осіб.
- Ефективно навчайте команду про переваги нової системи.
- Переконайтеся, що занепокоєння зацікавлених сторін адекватно вирішуються, а відгуки враховуються.
- Визначте чіткі та добре визначені ролі для членів команди, залучених до впровадження.
2. Співпраця з професійними ІТ-постачальниками
Визнання складності
- Визнайте складність і досконалість технології CDSS.
- Розумійте, що готові рішення CDSS можуть не задовольнити всі унікальні вимоги.
Використання ІТ-експертизи
- Співпрацюйте з професійними ІТ-компаніями, такими як Stfalcon, які спеціалізуються на технологіях охорони здоров'я.
- Шукайте постачальників з експертизою у розробці та впровадженні CDSS.
Потреби в налаштуванні
- Визначте унікальні функціональні можливості, які потрібні, і оцініть потребу в налаштуванні системи.
- Переконайтеся, що обраний ІТ-постачальник може надати необхідні налаштування та адаптацію.
Можливості навчання
- Використовуйте співпрацю з ІТ-постачальниками для навчання внутрішніх ресурсів.
- Підвищуйте внутрішню експертизу у складностях та технічних аспектах розробки та обслуговування CDSS.
Успішне впровадження CDSS вимагає не лише технічної експертизи, але й ефективної співпраці, навчання зацікавлених сторін та вирішення організаційних питань. Дотримуючись цього контрольного списку, організації охорони здоров'я можуть орієнтуватися у складностях та забезпечити більш плавну інтеграцію CDSS у свої існуючі системи та процеси.
Найкращі практики впровадження системи підтримки клінічних рішень
Система підтримки клінічних рішень (CDSS) є важливим компонентом інформаційних технологій у сфері охорони здоров'я, надаючи дані та знання, специфічні для пацієнтів, для покращення прийняття рішень для пацієнтів, клініцистів та персоналу. Використання найкращих практик при впровадженні CDSS є важливим для забезпечення оптимальної функціональності та позитивних результатів. Ось ключові найкращі практики:
Оцінка навантаження
- Співпрацюйте з постачальниками програмного забезпечення для визначення навантаження, пов'язаного з впровадженням CDSS.
- Оцініть необхідні ІТ-ресурси для адекватної підтримки функціональності.
- Оцініть клінічну експертизу постачальників програмного забезпечення для забезпечення точного налаштування.
Структурований дизайн системи
- Проектуйте та впроваджуйте CDSS зі структурованою системою для оптимізації потоку даних.
- Впроваджуйте процеси управління для постійного контролю та своєчасного усунення помилок.
Актуалізація даних
- Забезпечте регулярне оновлення даних для ефективної функціональності CDSS.
- Інтегруйте систему з різними джерелами даних для полегшення точного та своєчасного оновлення даних.
Інтеграція клінічних настанов
- Інтегруйте клінічні настанови та набори замовлень у CDSS для ефективного дизайну звітів без компромісу в ефективності.
- Використовуйте різні шаблони для створення документів та надавайте діагностичну підтримку.
Налаштування для оптимізації робочих процесів
- Налаштуйте інструменти CDSS для оптимізації клінічних робочих процесів як для пацієнтів, так і для медичних працівників.
- Впроваджуйте нагадування та інструменти, адаптовані до специфічних потреб пацієнтів та клініцистів.
Навчання зацікавлених сторін
- Навчайте медичних працівників, пацієнтів та персонал перевагам та функціональності CDSS.
- Організовуйте навчальні сесії для забезпечення ефективного використання системи.
Безперервний моніторинг та оцінка
- Впроваджуйте механізми безперервного моніторингу для оцінки ефективності CDSS.
- Регулярно оцінюйте та оновлюйте систему, щоб включити новітні досягнення в галузі охорони здоров'я.
Зручний інтерфейс
- Розробіть зручний інтерфейс для легкого навігації та прийняття медичними працівниками.
- Пріоритизуйте простоту для підвищення залученості користувачів та загальної ефективності.
Впроваджуючи ці найкращі практики, організації охорони здоров'я можуть максимізувати переваги впровадження CDSS, забезпечуючи покращене прийняття рішень, оптимізацію робочих процесів та підвищену якість догляду за пацієнтами.
Наш досвід
HospApp
Наш клієнт уявляв розробку сучасної мобільної системи, яка сприяє безперешкодній комунікації серед медичних працівників у рамках груп, що складаються з конкретних пацієнтів. Ця інноваційна платформа забезпечує ефективну взаємодію, обмін файлами, управління рецептами та виконання завдань, адаптованих до потреб окремих пацієнтів у визначених групах. Важливо, що вся інформація про пацієнтів залишається підвищено захищеною, обмеженою цифровими стінами лікарні.
Ключові цілі системи:
- Скорочення часу очікування пацієнтів: Підвищення якості обслуговування шляхом зменшення часу очікування пацієнтів.
- Швидка реакція на надзвичайні ситуації: Забезпечення швидких та ефективних відповідей на надзвичайні ситуації, що зменшує ризики для пацієнтів.
- Автоматизація для персоналу: Оптимізація документації, взаємодії та управлінських завдань, автоматизуючи рутинні процеси для медичного персоналу.
- Безпечне інформаційне середовище: Забезпечення конфіденційності та безпеки інформації про пацієнтів, запобігаючи витоку даних з безпечного цифрового екосистеми лікарні.
- Зручний інтерфейс: Розробка інтуїтивно зрозумілого та зручного інтерфейсу, який нагадує популярні месенджери, що забезпечує легкість використання для осіб, знайомих із платформами обміну повідомленнями.
Головна мета - трансформувати надання медичних послуг, використовуючи технології для покращення співпраці, автоматизації процесів та надання зручного інтерфейсу для медичних працівників, що в кінцевому підсумку приносить користь як постачальникам медичних послуг, так і пацієнтам.
IsDocIn
Основною метою цього проекту було розробити мобільний застосунок для спрощення процесу запису на прийом для осіб, які шукають медичні консультації. Застосунок орієнтований як на пацієнтів, так і на лікарів, пропонуючи платформу для безперешкодного управління записами.
Ключові функції та досягнення:
- Дизайн інтерфейсу: Розроблено зручний інтерфейс, адаптований для пацієнтів, що забезпечує легкість використання та позитивний досвід.
- Версії для iOS та Android: Розроблено комплексні дизайни для платформ iOS та Android, оптимізуючи користувацький досвід на різних пристроях.
- Розробка нативних застосунків: Впроваджено розроблений UI в повнофункціональні нативні застосунки, що забезпечують оптимізовану продуктивність та специфічні для платформи функціональні можливості.
- Профілі лікарів та сповіщення: Дозволено лікарям створювати профілі в застосунку, надаючи важливу інформацію для пацієнтів.
- Реалізовано систему сповіщень, щоб інформувати лікарів, коли з ними заброньовано прийом.
Успішно створивши мобільний застосунок, що спрощує процес запису на прийом, цей проект мав на меті підвищити доступність медичних послуг, забезпечуючи зручність як для пацієнтів, так і для медичних працівників.
Висновок
Розробка та впровадження системи підтримки клінічних рішень вимагає спеціалізованої експертизи в галузі ІТ телемедичних послуг. Вам потрібна команда ІТ-фахівців, яка не лише володіє технологіями розробки, але й має глибоке розуміння фінансових, регуляторних та адміністративних нюансів, властивих розробці медичних інструментів. Це критично важливо для забезпечення безпеки пацієнтів та захисту критичної інформації від кіберзагроз.
У Stfalcon ми маємо експертизу та досвід, необхідні для створення надійного та повністю індивідуального телемедичного програмного забезпечення для медичних організацій. Наша мета — підвищити внутрішній контроль, ефективність та медичні послуги. Як провідна компанія з розробки медичного програмного забезпечення, ми надаємо ресурси, необхідні для успішної розробки повністю налаштованої системи підтримки клінічних рішень (CDSS), адаптованої до унікальних потреб вашої організації. Напишіть нам для отримання інноваційних рішень та трансформаційного медичного досвіду.

 Читати кейс
Читати кейс
 Читати кейс
Читати кейс


